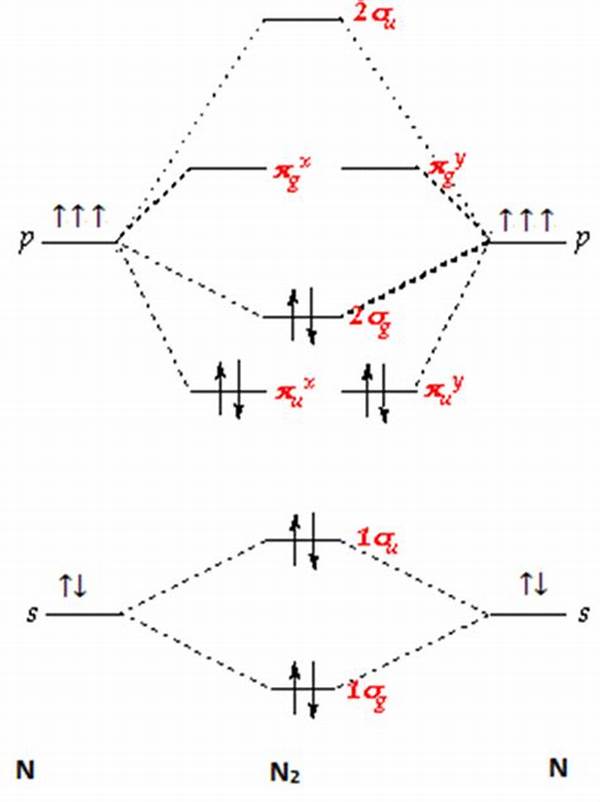
Teori Orbital Molekul (Molecular Orbital Theory / MOT) adalah salah satu teori paling fundamental dalam kimia kuantum yang menjelaskan bagaimana atom-atom berikatan untuk membentuk molekul, dengan melihat interaksi dan kombinasi orbital atom yang membentuk orbital molekul. Teori ini memberikan pemahaman yang lebih dalam dan akurat tentang struktur elektronik molekul, kestabilan ikatan, serta sifat magnetik dan spektroskopik suatu senyawa.
Tidak seperti teori ikatan valensi yang fokus pada pasangan ikatan antaratom, MOT memandang bahwa elektron dalam molekul tidak lagi terikat pada satu atom, melainkan tersebar dalam orbital molekul yang melingkupi seluruh molekul. Ini berarti elektron berada dalam keadaan terdelokalisasi, dan berkontribusi terhadap keseluruhan struktur molekul.
Prinsip Dasar Teori Orbital Molekul
-
Kombinasi Linier Orbital Atom (LCAO)
Orbital molekul terbentuk dari gabungan dua atau lebih orbital atom yang berinteraksi. Gabungan ini dapat bersifat:-
Ikatan (bonding): hasil penambahan konstruktif dari orbital atom → menurunkan energi → menstabilkan molekul.
-
Antiikatan (antibonding): hasil penjumlahan destruktif → menaikkan energi → melemahkan ikatan.
-
Non-ikatan (nonbonding): jika orbital tidak cukup tumpang tindih.
-
-
Orbital Molekul Terisi oleh Elektron
Elektron mengisi orbital molekul sesuai dengan aturan:-
Aufbau (mengisi dari energi terendah)
-
Prinsip Pauli (dua elektron per orbital dengan spin berlawanan)
-
Aturan Hund (pengisian orbital setara secara paralel dulu)
-
-
Bilangan Ikatan (Bond Order)
Digunakan untuk menentukan kekuatan dan jumlah ikatan dalam molekul:
Bond Order = ½ × (jumlah elektron bonding – jumlah elektron antibonding)
Semakin tinggi bond order → ikatan lebih kuat dan stabil.
Contoh Aplikasi MOT
-
Pada molekul O₂, MOT menjelaskan dengan tepat bahwa molekul ini bersifat paramagnetik karena memiliki dua elektron tak berpasangan di orbital molekul antibonding π* — sesuatu yang tidak dapat dijelaskan oleh teori ikatan valensi biasa.
-
Dalam molekul H₂, dua orbital 1s dari dua atom hidrogen membentuk orbital bonding σ1s dan antibonding σ*1s. Dua elektron mengisi orbital bonding, menghasilkan molekul yang sangat stabil.
Keunggulan dan Aplikasi
-
Lebih akurat untuk sistem multi-atom atau molekul kecil
-
Dapat memprediksi sifat magnetik, spektroskopik, dan reaktivitas molekul
-
Sangat penting dalam kimia kuantum, kimia organologam, fotokimia, dan rekayasa material elektronik
-
Digunakan dalam komputasi kimia untuk simulasi dan visualisasi orbital molekul dengan bantuan software seperti Gaussian, ORCA, atau Avogadro
Kesimpulan
Teori Orbital Molekul adalah jendela menuju dunia elektronik molekul yang sebenarnya. Dengan melihat elektron sebagai gelombang yang terdelokalisasi dalam molekul, MOT memungkinkan para ilmuwan memprediksi dan menjelaskan berbagai sifat kimia yang tidak terjangkau oleh teori klasik. Ini menjadikannya landasan penting dalam pengembangan material baru, obat, katalis, dan teknologi molekuler mutakhir.