Abstrak
Kami melaporkan urutan dua langkah untuk konstruksi enantioselektif dari keluarga langka atropisomer C(sp 2 )─C(sp 3 ) stabil yang menampilkan dua pusat stereogenik tambahan. Proses ini dimulai dengan dihidrobenzofuranulasi yang dikatalisis organo yang membentuk dan mengendalikan stereokimia dua pusat karbon, diikuti oleh fungsionalisasi diastereoselektif yang sangat tinggi yang secara signifikan meningkatkan penghalang terhadap diastereomerisasi ikatan C(sp 2 )─C(sp 3 ), yang secara efektif mengunci dan menstabilkan konfigurasinya.
Perkenalan
Atropisomerisme, suatu bentuk stereoisomerisme yang timbul dari rotasi terbatas di sekitar ikatan tunggal, memainkan peran penting dalam kimia organik modern, khususnya dalam pengembangan farmasi, [ 1 – 4 ] desain katalis dan ligan, [ 5 – 8 ] dan bahan fungsional. [ 9 – 14 ] Sementara kemajuan signifikan telah dibuat dalam sintesis enantioselektif atropisomer C(sp 2 )─C(sp 2 ), [ 15 – 17 ] konstruksi enantioselektif dari keluarga atropisomerik yang kurang umum, [ 18 , 19 ] khususnya atropisomer C(sp 2 )─C(sp 3 ), sebagian besar masih kurang dieksplorasi, meskipun kemunculannya dalam berbagai produk alami. [ 20 – 24 ] Khususnya, rotasi terbatas di sekitar ikatan C(sp 2 )─C(sp 3 ) dalam bisnikalaterin B [ 25 – 27 ] menghasilkan kombinasi khas elemen stereogenik sentral dan aksial, keduanya berpusat pada satu atom (Skema 1a ). [ 28 , 29 ] Fitur stereokimia yang luar biasa ini juga ditemukan dalam ustiloksin siklodepsipeptida, [ 30 ] di mana atropisomerisme secara alami terjadi secara eksklusif dalam bentuk sin . [ 31 ] Contoh penting lainnya adalah streptorubin B, yang ada sebagai campuran atropisomer 10:1 dengan penghalang diastereomerisasi sebesar 86 kJ.mol −1 . [ 32 – 34 ] Akses enantioselektif ke molekul yang menampilkan ikatan stereogenik C(sp 2 )─C(sp 3 ) masih belum banyak dieksplorasi, dengan hanya beberapa contoh yang dilaporkan dalam literatur. Kelangkaan ini terutama disebabkan oleh hambatan rendah terhadap diastereomerisasi yang terkait dengan keluarga atropisomer yang aneh ini. [ 35 – 39 ] Baik kelompok kami [ 40 ] dan kemudian tim Hayashi [ 41 – 43 ] telah menghadapi tantangan ini, memanfaatkan C(sp 2 )─C(sp 3) atropisomer dengan hambatan diastereomerisasi rendah sebagai perantara untuk mengendalikan sumbu stereogenik dalam atropisomer biaryl klasik. Pada tahun 2017, Bencivenni melaporkan contoh pertama kontrol termodinamika atas sumbu stereogenik C(sp 2 )─C(sp 3 ) (Skema 1b ). [ 44 ]
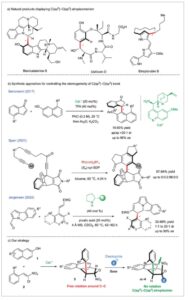
Skema 1
Buka di penampil gambar
Presentasi PowerPoint
Pentingnya atropisomer C(sp 2 )─C(sp 3 ) dan strategi untuk sintesis enantioselektifnya.
Mereka mencapai terobosan ini melalui alkilasi Friedel–Crafts tipe enantioselektif dari inden-1-on yang difungsikan secara sesuai dengan 2-naftol yang disubstitusi-8, menggunakan amina primer kiral yang berasal dari quinidine sebagai katalis. Sebagai alternatif, Sparr mengembangkan siklotrimerisasi [2 + 2 + 2] yang dikatalisis oleh rhodium enantioselektif yang elegan, yang memungkinkan pembentukan eksklusif stereoisomer tunggal di antara enam isomer yang mungkin, dengan stereokontrol mencapai rasio stereoisomerik 0:0:2:98:0:0 yang mengesankan. [ 45 ] Penemuan ini dicapai melalui desain turunan 9-ariltriptikena kiral, yang menampilkan sumbu stereogenik C(sp 2 )─C(sp 3 ) yang distabilkan oleh enam penghalang rotasi tinggi, sehingga mencegah interkonversi antara diastereomer. Akhirnya, kelompok Jørgensen menerbitkan salah satu contoh pertama sintesis multistereogenik yang menggabungkan ikatan C(sp 2 )─C(sp 3 ) yang stabil secara konformasional di samping dua pusat stereogenik yang berurutan. [ 46 ] Strategi organokatalitik mereka memfasilitasi penambahan 5 H -benzo[ a ]pyrrolizine-3-carbaldehydes ke akseptor Michael, yang mengarah ke produk siklisasi yang sesuai dengan hasil yang baik (hingga 69%), dan enantioselektivitas dan diastereoselektivitas sedang hingga sangat baik (hingga 99% ee , dari 1:1 hingga >20:1 dr ). Metodologi yang dirancang khusus untuk sintesis enantioselektif atropisomer C(sp 2 )─C(sp 3 ) masih langka, dan mencapai enantioselektivitas dan skalabilitas yang tinggi terus menjadi tugas yang menantang. [ 47 ] Desain reaksi yang mampu menghasilkan atropisomer C(sp 2 )─C(sp 3 ) yang beragam secara struktural dengan kompatibilitas gugus fungsi yang luas sangat penting untuk memperluas utilitas sintetisnya. Berdasarkan minat kami dalam sintesis trans -dihidrobenzofuran 3 melalui siklisasi domino Michael/ O yang dikatalisis organo antara naftol 1 dan kloronitrolakena 2 , [ 48 – 53 ] kami merancang strategi yang efisien untuk membangun keluarga molekul baru yang menggabungkan beberapa elemen stereogenik. Pendekatan ini melibatkan alkilasi diastereoselektif sederhana dari dihidrobenzofuran 3 dengan elektrofil, menghasilkan senyawa yang mengandung ikatan C(sp 2 )─C(sp 3 ) yang stabil secara konformasi dan dua pusat stereogenik. Khususnya, transformasi kunci ini memposisikan gugus nitro dalam cis-konfigurasi relatif terhadap cincin aromatik, secara efektif meningkatkan penghalang terhadap diastereomerisasi dan menstabilkan konformasi atropisomerik.
Hasil dan Pembahasan
Berdasarkan pertimbangan di atas, studi komputasional awal dilakukan pada dihidrobenzofuran 3a dan 4a . [ 54 ] Dihidrobenzofuran 3a dan 4a dapat mengadopsi dua konformasi, antiklinal ( ac ) dan sinklinal ( sc ), yang dihasilkan dari rotasi di sekitar ikatan C─C (Skema 2a ). Menurut nomenklatur Klyne–Prelog, [ 55 ] konformasi ditentukan oleh sudut dihedral antara ikatan merah dan biru. Konformer utama, ac – 3a , mengadopsi konformasi antiklinal, sedangkan konformer minor, sc- 3a , menunjukkan konformasi sinklinal. Khususnya, hanya diastereomer ac – 3a yang terdeteksi oleh 1 H NMR, mungkin karena penghalang rendah untuk diastereomerisasi yang dihitung pada 60,1 kJ.mol -1 dan perbedaan energi yang signifikan antara diastereomer ac – 3a dan sc – 3a (ΔΔ G = 6,0 kJ.mol -1 , Skema 2b ). Dihidrobenzofuran ac – 4a disintesis melalui adisi Michael antara 3a dan 5a dalam kondisi basa. Seperti yang diharapkan, konfigurasi cis relatif antara gugus NO2 dan 2-bromofenil secara signifikan meningkatkan penghalang untuk diastereomerisasi hingga 163,0 kJ.mol -1 antara diastereomer ac – 4a dan sc – 4a . Selain itu, energi potensial sc – 4a ditemukan sebesar 19,8 kJ.mol −1 lebih tinggi daripada ac – 4a (Skema 2c ), yang menunjukkan bahwa ac – 4a secara termodinamika lebih disukai, dengan rasio kelimpahan sekitar 99,9:0,1 pada suhu 23 °C. Selain itu, seperti yang ditunjukkan oleh peta IGM (Skema 2c ), [ 56 , 57 ] konfigurasi cis relatif antara NO 2dan gugus 2-bromofenil sangat meningkatkan penghalang terhadap diastereomerisasi. Peta IGM menganalisis gradien kerapatan elektron dalam sistem molekuler untuk mengidentifikasi wilayah ruang tempat interaksi kimia terjadi. Peta IGM jauh lebih besar dan lebih tolak-menolak, bahkan dengan beberapa area merah yang sangat tolak-menolak, pada 4a dibandingkan dengan 3a .
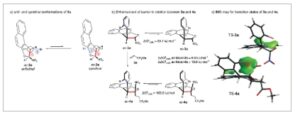
Skema 2
Buka di penampil gambar
Presentasi PowerPoint
Perhitungan awal untuk penghalang diastereomerisasi untuk dihidrobenzofuran 3a dan 4a (semua perhitungan dilakukan dalam fase gas).
Berdasarkan perhitungan awal yang menjanjikan ini, kami melanjutkan untuk mengoptimalkan penambahan Michael antara substrat model 3a dan 5a sebagai akseptor Michael (Tabel 1 ). [ 58 , 59 ] Dalam kondisi dasar, zat antara nitronat kiral 7 dihasilkan dan selanjutnya terperangkap oleh akrilat elektrofilik 5a , yang mendekat dari sisi berlawanan dari gugus 2-bromofenil. Perhitungan DFT memperkirakan penghalang diastereomerisasi antara nitronat ac- dan sc- 7 pada 52 kJ.mol −1 . Seperti yang diharapkan, penghalang ini lebih rendah daripada penghalang substrat 3a karena penghilangan proton oleh basa menyebabkan lebih sedikit halangan sterik untuk berpindah dari satu konformer ke konformer lainnya. Kami juga menemukan bahwa ac- dan sc -nitronat 7 memiliki sedikit perbedaan energi, dengan preferensi untuk konformer ac , yang sesuai dengan rasio ac / sc sebesar 4:1 pada 298 K. Ketika DBU digunakan sebagai basa, pembentukan eksklusif atropisomer benzofuran 6a diamati (hasil 76%), kemungkinan besar dihasilkan dari eliminasi HNO2 dari 4a melalui mekanisme tipe E2 (entri 1). Sebaliknya, penggunaan basa yang lebih lemah secara selektif menghasilkan produk yang diinginkan 4a hanya ketika K2CO3 digunakan , menghasilkan hasil sedang (50%, entri 5) sambil mempertahankan enantiopuritas tinggi (96% ee ) (entri 2–5). Beralih ke basa hidroksida menghasilkan hasil yang lebih baik sambil meminimalkan degradasi (entri 6 dan 7 ) . Optimalisasi lebih lanjut, termasuk menurunkan suhu hingga 0 °C (entri 8) dan meningkatkan jumlah ekuivalen 5a (3 ekuivalen, entri 9), menghasilkan peningkatan hasil.
Tabel 1. Optimasi kondisi reaksi. a)
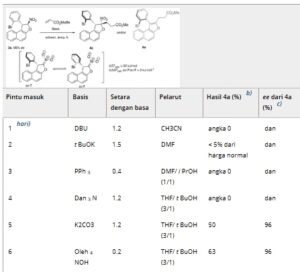
a) Kondisi reaksi: 3a (1,0 ekuivalen), 5a (1,5 ekuivalen) dan basa digabungkan dengan pelarut [0,1 M] pada suhu 20°C selama 1 jam.
b) Hasil isolasi produk murni analitis setelah pemurnian dengan kromatografi kilat.
c) Ditentukan dengan HPLC pada fase stasioner kiral.
d) 76% dari 6a terbentuk.
e) reaksi dijalankan pada suhu 0°C.
f) 3 ekuivalen 5a .
g) 10% dari 6a diperoleh.
h) reaksi dijalankan pada suhu −10°C.
Pada suhu ini, tetrabutilamonium hidroksida mengungguli Triton B (entri 10), sedangkan natrium hidroksida menyebabkan degradasi parsial dan hasil yang berkurang (entri 11). Khususnya, melakukan reaksi dalam THF saja mengakibatkan pembentukan produk eliminasi 6a dalam hasil yang rendah (entri 12), bahkan pada suhu yang lebih rendah (entri 13). Berdasarkan hasil ini, kondisi yang dioptimalkan dari entri 10 dipilih untuk mengeksplorasi cakupan reaksi.
Dengan kondisi reaksi yang dioptimalkan, kami mengeksplorasi generalitas pendekatan enantioselektif ini terhadap atropisomer C(sp 2 )─C(sp 3 ) baru dengan beragam nitroalkena (Skema 3 ). Kelompok aril 2-substitusi lainnya yang mengandung atom klorin dan iodin menghasilkan dihidrobenzofuran 4b dan 4c dengan hasil yang baik dan stereoselektivitas yang sangat baik (>20:1 dr , >94% ee ). Selain itu, penggabungan kelompok nitro dalam 4d dan kelompok metil dalam 4e menghasilkan efisiensi yang sebanding (>20:1 dr , >94% ee ). Sebaliknya, penggabungan gugus 2-metoksinaftil menghasilkan campuran atropisomer sc- 4g dan ac- 4g yang tidak dapat dipisahkan dengan hasil dan diastereoselektivitas yang lebih rendah (2:1 dr ), [ 60 ] sambil mempertahankan enantioselektivitas yang tinggi (96% ee ). Dalam kasus ini, penggunaan gugus 2-metoksi naftil membuat substrat 3g jauh kurang reaktif, yang dapat menjelaskan hasil yang lebih rendah. Selain itu, stereodiferensiasi pada pembentukan ikatan C─C selama penambahan Michael kurang efisien karena kedua posisi orto tersubstitusi, yang dapat menjelaskan diastereoselektivitas yang rendah. Selanjutnya, penggabungan substituen bromo baik pada posisi 6 maupun posisi 3 dari cincin naftol menghasilkan atropisomer 4h dan 4i dengan hasil sedang dan diastereoselektivitas yang sangat baik (>20:1 dr ). Namun, posisi substituen bromo berdampak pada enantioselektivitas, yang sedikit menurun dari 96% ( 4h ) menjadi 80% ( 4i ). Setelah itu, kami mengeksplorasi cakupan substrat dengan berbagai akseptor Michael. Reaksi berlangsung secara efisien dengan enon 5b dan akrilonitril 5c , menghasilkan atropisomer terfungsionalisasi 4j dan 4k , masing-masing, dengan hasil yang sebanding dan stereoselektivitas tinggi (>20:1 dr , 95% ee ). Memperluas protokol ke aduk Baylis–Hillman 5d memerlukan kondisi yang dimodifikasi, menggunakan K₂CO₃ dalam aseton pada suhu 23 °C. Di bawah kondisi ini, turunan bromo dan iodo 4l dan 4m diperoleh dengan hasil yang baik dan diastereo- dan enantioselektivitas yang sangat baik (>20:1 dr , >94% ee). Berikutnya, strategi pembentukan ikatan C─halogen alternatif dieksplorasi untuk lebih memperluas sintesis atropisomer C(sp 2 )─C(sp 3 ). Khususnya, penerapan kondisi reaksi sebelumnya dengan adanya N -klorosuksimida 5e memungkinkan pembentukan klorida alkil tersier yang stabil 4n dan 4o dengan hasil yang sangat baik (>87%) dan enantioselektivitas yang tinggi (>92% ee ), meskipun dalam kedua kasus ini, sedikit penurunan diastereoselektivitas diamati. Halogenasi juga dimungkinkan menggunakan NBS, dengan pembentukan 4p yang bersih dalam hasil 89%, diastereoselektivitas yang sedikit lebih baik (8:1 dr) dan enantioselektivitas yang sangat baik (96% ee). Selain itu, penggunaan aldehida aromatik sebagai mitra elektrofilik terbukti layak, memperkenalkan stereosentra tambahan dalam 4q (1,7:1 dr, 97% ee ), meskipun dengan hasil sedang (27%). Akhirnya, analisis difraksi sinar-X kristal tunggal dari atropisomer 4a , 4c, dan 4l secara jelas mengkonfirmasi konfigurasi absolut mereka sebagai ac , R , R . [ 61 ]
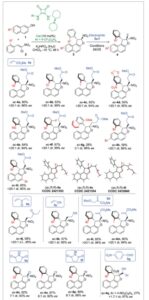
Skema 3
Buka di penampil gambar
Presentasi PowerPoint
Kondisi reaksi untuk langkah kedua: a) 5a , 5b, atau 5c (3,0 ekuivalen), Bu4NOH ( 0,2 ekuivalen), THF/ t BuOH 3:1, 0 °C, 2 jam. b) 5d ( 1,5 ekuivalen), K2CO3 ( 1,5 ekuivalen), aseton, 23 °C, 12 jam. c) 5e atau 5f ( 1,5 ekuivalen), K2CO3 ( 1,5 ekuivalen), etil asetat, 23 °C, 16 jam. d) 5g (2,0 ekuivalen), Bu4NOH ( 0,2 ekuivalen), THF/ t BuOH 3:1, 0 ° C , 2 jam. Hasil mengacu pada langkah kedua.
Akhirnya, tidak hanya turunan 2-naftol yang dapat digabungkan dalam struktur akhir tetapi juga 1,3-dikarbnonil, bahkan jika yang terakhir menyebabkan hambatan yang lebih rendah terhadap diastereomerisasi di sekitar ikatan C(sp 2 )─C(sp 3 ) (vide infra) dan memerlukan penggunaan gugus aril o,o’- disubstitusi pada nitroalkena awal 2 (Skema 4 ). Hebatnya, atropisomer sc – 4r diperoleh dalam hasil 75% dengan stereoselektivitas tinggi (>20:1 dr , 84% ee ) ketika 2-hidroksi-1,4-naftokuinon digunakan sebagai bahan awal. Demikian pula, memperluas protokol ke dimedon menyebabkan pembentukan atropisomer sc – 4s dengan hasil 64%. Meskipun diastereoselektivitasnya sedikit menurun menjadi 15:1, ia mempertahankan enantioselektivitas yang sangat baik (96% ee ). Dalam kasus 4s , VT- 1 H NMR dengan jelas menunjukkan bahwa memanaskan campuran diastereomerik 15:1 dari sc – 4s pada 50 °C selama beberapa jam mengakibatkan pembentukan rotamernya ac – 4s dengan kesetimbangan termodinamika yang ditetapkan pada rasio 2,1:1, yang sesuai dengan perbedaan energi sebesar 2,1 kJ.mol −1 (Skema 5 ). Hal ini memungkinkan kami untuk secara eksperimental menentukan penghalangnya terhadap diastereomerisasi pada 107,7 kJ.mol −1 , yang setara dengan waktu paruh rasemisasi selama 9 hari pada 25 °C (lihat Informasi Pendukung untuk detailnya). Sebagai pelengkap, perhitungan DFT memperkirakan penghalang terhadap diastereomerisasi untuk sc – 4s pada 114,2 kJ.mol −1 , yang menunjukkan kesesuaian yang sangat baik antara eksperimen dan model. Percobaan VT- 1 H-NMR serupa dilakukan pada senyawa 4t , yang menunjukkan penghalang yang lebih tinggi terhadap diastereomerisasi sebesar 132,3 kJ.mol −1 , yang sesuai dengan waktu paruh rasemisasi 1 hari pada 110 °C (lihat Informasi Pendukung ). Akhirnya, ac – 4u diperoleh dengan hasil yang baik (76%), meskipun dalam kasus ini, diastereoselektivitas antara atropodiastereomer ac dan sc lebih rendah ( ac – 4u / sc – 4u = 3,5:1). Hal ini mungkin disebabkan oleh perbedaan yang kurang kentara dalam hal halangan sterik antara substituen bromo dan naftil.
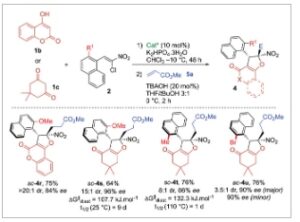
Skema 4
Buka di penampil gambar
Presentasi PowerPoint
Perluasan cakupan menggunakan 1,3-dikarbonil sebagai bis-pronukleofil.
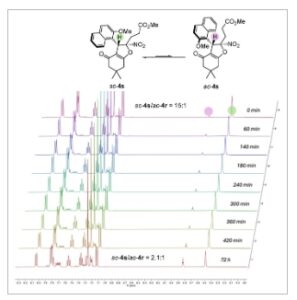
Skema 5
Buka di penampil gambar
Presentasi PowerPoint
Spektrum VT- 1 H NMR (bagian relevan) untuk pembentukan ac – 4r .
Untuk mengevaluasi ketahanan metode, percobaan skala gram dilakukan (Skema 6a ). Dimulai dari satu gram substrat 3c dalam kondisi standar, ac – 4c diperoleh dengan hasil 76% tanpa kehilangan enantiopuritas. Selain itu, pasca-fungsionalisasi atropisomer 4a dan 4c dilakukan untuk mengevaluasi utilitas praktis dari metode sintetis saat ini (Skema 6b ).
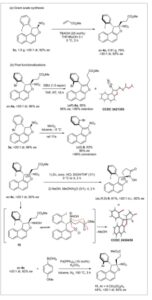
Skema 6
Buka di penampil gambar
Presentasi PowerPoint
a) Sintesis skala Gram dan b) reaksi pasca-fungsionalisasi.
Sebagai bagian dari studi ini, kami mengeksplorasi eliminasi E2 dari HNO 2 , sebuah transformasi yang sebelumnya diamati selama optimasi penambahan Michael (lihat Tabel 1 ). Setelah optimasi (lihat Informasi Pendukung ), perlakuan ac – 4a dengan DBU sebagai basa dalam THF pada suhu kamar selama 16 jam menghasilkan atropisomer benzofuran ( aR ) – 6a yang diharapkan dengan hasil 95% dan retensi kiralitas aksial yang lengkap. [ 62 ] Konfigurasinya telah ditetapkan oleh analisis difraksi sinar-X kristal tunggal (SCXRD), [ 61 ] dan yang menarik, ia berlawanan dengan nitrobenzofuran ( aS ) – 8 , yang diperoleh melalui konversi kiralitas sentral-ke-aksial oksidatif, [ 52 ] menggunakan MnO 2 sebagai oksidan. Dalam kondisi sebelumnya, kesetimbangan konformasi cepat di sekitar ikatan C(sp 2 )─C(sp 3 ) pada 3a memungkinkan pembentukan selektif ( aS )- 8 , mengikuti prinsip Curtin–Hammett. Sebaliknya, transformasi saat ini melibatkan aromatisasi dengan eliminasi E2 HNO 2 untuk menghasilkan ( aR )- 6a dan terjadi secara eksklusif dari ac – 4a yang konformasinya di sekitar ikatan C(sp 2 )─C(sp 3 ) diblokir.
Bahasa Indonesia: Sebagai pelengkap, reduksi gugus nitro dalam ac – 4c menggunakan seng dan asam klorida pekat menghasilkan N- hidroksilaktam ( ac,R,S) -9 secara diastereoselektif dengan hasil yang baik sambil mempertahankan enantiopuritas, [ 63 , 64 ] dengan proses yang terjadi melalui inversi konfigurasi pada atom karbon stereogenik yang mengandung gugus nitro seperti yang ditunjukkan oleh analisis difraksi sinar-X kristal tunggal. [ 61 ] Ini mungkin muncul melalui epimerisasi perantara hemiaminal sementara 10 melalui proses pembukaan/penutupan cincin. Sebagai alternatif, Suzuki cross-coupling dari 4c dengan asam 4-metoksifenilboronat yang dikatalisis oleh Pd(PPh3 ) 4 menghasilkan produk yang diinginkan 11 dengan hasil 44%, dengan retensi enantiopuritas lengkap (92% ee ) dan tidak ada diastereomerisasi yang terdeteksi di bawah kondisi termal yang diterapkan (100 °C, 3 jam). Hasil ini menyoroti stabilitas konfigurasi yang luar biasa dari kelas atropisomer C(sp 2 )─C(sp 3 ) yang baru ini.
Akhirnya, sifat-sifat kiroptis dari ( ac,R,R ) -4a dievaluasi melalui pengukuran spektral ECD dan VCD dan dibandingkan dengan kalkulasi teoritis (Gambar 1 , lihat Informasi Pendukung untuk detailnya). Spektrum VCD yang diukur (berwarna hijau) menunjukkan korelasi yang kuat dengan spektrum yang dihitung, menunjukkan kesesuaian yang memuaskan (Gambar 1 , atas). Sebagian besar pita vibrasi yang dihitung selaras dengan data eksperimen, kecuali dua pita pada sekitar 1570 dan 1200 cm −1 , yang tidak dimodelkan secara akurat. Perbedaan ini kemungkinan besar disebabkan oleh tantangan dalam memodelkan dengan benar mode vibrasi gugus NO2 , serta kemungkinan keterlibatan interaksi intermolekul yang lemah. Mengenai ECD, spektrum yang dihitung untuk konformasi dominan molekul hampir identik (Gambar 1 , bawah). Pengamatan ini dapat dikaitkan dengan fakta bahwa orbital molekul yang bertanggung jawab atas transisi elektronik yang terkait dengan pita yang diukur terutama terletak pada bagian kaku molekul, dengan kontribusi minimal dari gugus metil propanoat, yang menunjukkan fleksibilitas konformasi yang lebih besar. Akibatnya, dengan mengintegrasikan VCD, ECD, dan pemodelan molekul (DFT dan TD-DFT), konfigurasi absolut ( ac,R,R )- 4a dikonfirmasi dengan jelas, menguatkan penugasan yang sebelumnya ditentukan oleh analisis difraksi sinar-X kristal tunggal.
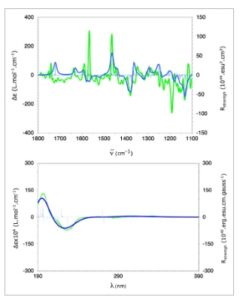
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Spektrum VCD (atas) dan ECD (bawah) diukur (dalam warna hijau) untuk ( ac,R,R )- 4a dalam CH 2 Cl 2 dan CH 3 CN, masing-masing, dan dihitung (dalam warna biru) menggunakan TD(60)-SMD(ACN)/CAM- B3LYP/6–31++G(d,p)//SMD(ACN)/B3LYP/TZVP.
Kesimpulan
Singkatnya, kami telah mengembangkan strategi diastereo- dan enantioselektif yang tinggi untuk sintesis keluarga baru atropisomer C(sp 2 )─C(sp 3 ) yang menantang yang menggabungkan dua pusat stereogenik tambahan. Pendekatan ini bergantung pada dihidrobenzofuranulasi organokatalis enantioselektif dari prekursor sederhana, diikuti oleh penambahan Michael diastereoselektif yang sangat tinggi yang mengakomodasi berbagai mitra elektrofilik, yang memungkinkan kontrol yang tepat atas stereogenisitas C(sp 2 )─C(sp 3 ). Yang penting, hambatan terhadap diastereomerisasi diakses baik secara eksperimental maupun dengan perhitungan teoritis, yang menunjukkan stabilitas konfigurasi yang sangat baik dalam banyak kasus. Lebih jauh, atropisomer C(sp 2 )─C(sp 3 ) ini dapat dengan mudah diubah menjadi atropisomer benzofuran yang sesuai melalui eliminasi yang dipromosikan DBU secara langsung, yang menyoroti keserbagunaan dan utilitas sintetis dari metodologi ini.
